پاتولوژی آلزایمر: تجمع پلاکهای آمیلوئید و گرههای تائو در مغز
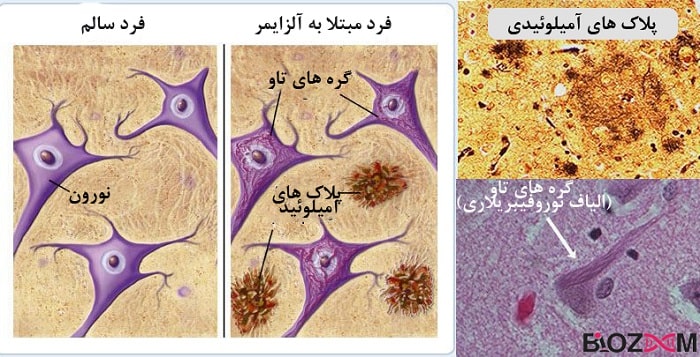
بیماری آلزایمر، شایعترین علت زوال عقل، از نظر پاتولوژیک با دو ویژگی اصلی در مغز مشخص میشود: تجمع پلاکهای آمیلوئید بتا و گرههای نوروفیبریلاری تائو. این دو عامل، به صورت مجزا و در تعامل با یکدیگر، منجر به آسیب و مرگ سلولهای عصبی (نورونها) میشوند که در نهایت به از دست دادن حافظه و کاهش عملکرد شناختی میانجامد. این تغییرات پاتولوژیک سالها قبل از بروز علائم بالینی آشکار، آغاز میشوند.
پلاکهای آمیلوئید بتا خارج سلولهای عصبی تشکیل میشوند. پروتئین پیشساز آمیلوئید (APP)، پروتئینی طبیعی است که در غشای سلولهای عصبی یافت میشود. در افراد مبتلا به آلزایمر، این پروتئین به طور غیرطبیعی توسط آنزیمهای خاصی برش میخورد و قطعات کوچکی به نام بتا-آمیلوئید (Aβ) تولید میشود. این قطعات Aβ، به ویژه Aβ42، تمایل زیادی به تجمع دارند و به هم میپیوندند تا ساختارهای نامحلولی به نام پلاکهای آمیلوئید را تشکیل دهند. این پلاکها به مرور زمان بزرگتر شده و در فضای بین نورونها رسوب میکنند و ارتباطات سلولی را مختل کرده و پاسخهای التهابی را برمیانگیزند.
در کنار پلاکهای آمیلوئید، گرههای نوروفیبریلاری تائو درون سلولهای عصبی شکل میگیرند. پروتئین تائو به طور طبیعی در پایدارسازی میکروتوبولها، که بخشی از اسکلت سلولی و سیستم حمل و نقل نورونها هستند، نقش دارد. در بیماری آلزایمر، پروتئین تائو دچار هایپرفسفریلاسیون (افزایش غیرعادی گروههای فسفات) میشود. این تغییر باعث میشود که تائو از میکروتوبولها جدا شده و به هم بپیوندد و رشتههای در هم تنیدهای را تشکیل دهد که به آنها گرههای نوروفیبریلاری میگویند. این گرهها عملکرد طبیعی نورونها را مختل کرده و منجر به از هم پاشیدگی سیستم حمل و نقل سلولی و در نهایت مرگ سلولهای عصبی میشوند.
تعامل بین پلاکهای آمیلوئید و گرههای تائو یکی از جنبههای کلیدی پاتولوژی آلزایمر است. به نظر میرسد تجمع آمیلوئید بتا میتواند آغازگر آبشار پاتولوژیک باشد که منجر به تغییرات در پروتئین تائو میشود. این دو پاتولوژی با همافزایی، باعث تخریب سیناپسها (نقاط ارتباطی بین نورونها)، التهاب عصبی و از دست دادن گسترده نورونها در مناطق حیاتی مغز مانند هیپوکامپ (مرکز حافظه) و قشر مغز میشوند. درک دقیق این مکانیسمها، گامی اساسی در جهت توسعه درمانهای مؤثر برای توقف یا معکوس کردن پیشرفت این بیماری ویرانگر است.